Introduction
Les catalyseurs jouent un rôle central dans la chimie, permettant d’accélérer les réactions chimiques sans être consommés au cours du processus. Ils sont essentiels dans de nombreuses industries, de la production de produits chimiques à la réduction des émissions polluantes. Cet article explore le rôle des catalyseurs, leurs types et leurs applications industrielles et environnementales.
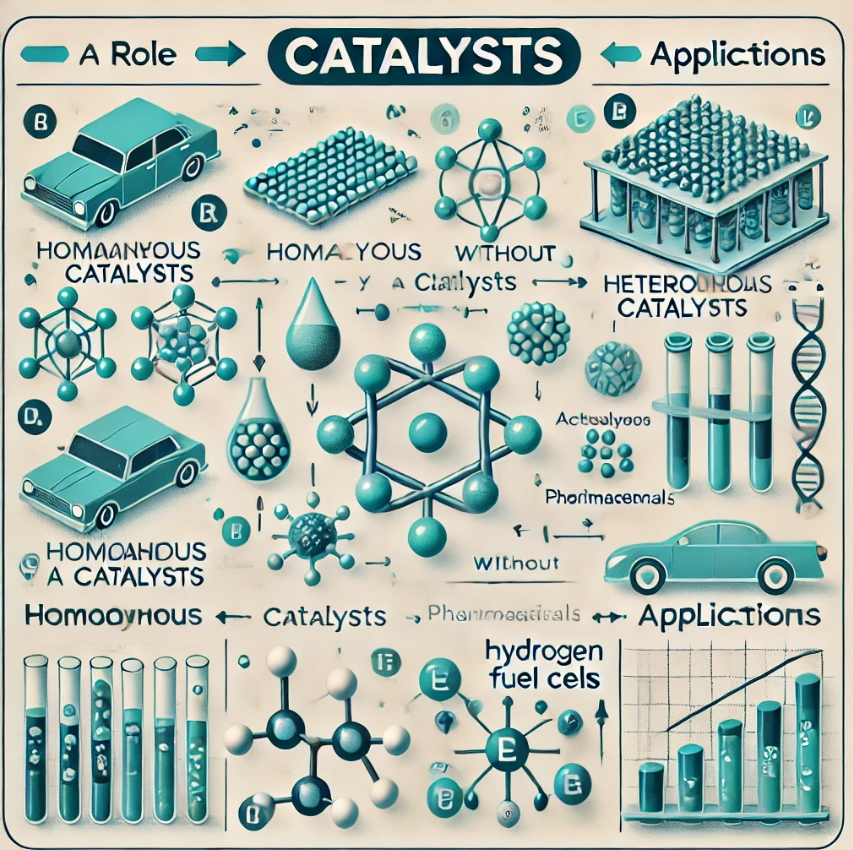
1. Qu’est-ce qu’un Catalyseur ?
Un catalyseur est une substance qui accélère une réaction chimique en abaissant l’énergie d’activation, c’est-à-dire l’énergie nécessaire pour que la réaction se produise. Les catalyseurs ne sont pas consommés pendant la réaction, ce qui signifie qu’ils peuvent être utilisés à plusieurs reprises.
Exemple classique de catalyse : L’utilisation du platinum dans les pots catalytiques pour accélérer la conversion des gaz d’échappement toxiques en composés moins nocifs.
Exemple visuel :
- Schéma de l’effet d’un catalyseur sur une réaction : Le catalyseur abaisse l’énergie d’activation, accélérant ainsi la réaction.
Les catalyseurs sont largement utilisés dans la chimie industrielle pour augmenter l’efficacité des procédés chimiques, réduire les coûts énergétiques, et minimiser les émissions polluantes.
2. Les Types de Catalyseurs
Les catalyseurs peuvent être classés en différentes catégories en fonction de leur nature et de leur mode d’action. Voici les principaux types de catalyseurs :
1. Catalyseurs Homogènes
Les catalyseurs homogènes sont des catalyseurs qui se trouvent dans la même phase que les réactifs, généralement sous forme liquide ou gazeuse. Ils sont solubles dans le milieu réactionnel, ce qui permet une interaction directe avec les réactifs.
Exemple : Les acides ou bases utilisés pour catalyser des réactions en solution, comme l’acide sulfurique dans la production d’esters.
2. Catalyseurs Hétérogènes
Les catalyseurs hétérogènes se trouvent dans une phase différente de celle des réactifs. Généralement, ils sont sous forme solide tandis que les réactifs sont sous forme liquide ou gazeuse. Ce type de catalyse est largement utilisé dans l’industrie car les catalyseurs hétérogènes sont plus faciles à séparer des produits après la réaction.
Exemple : Le platine dans les pots catalytiques ou le fer dans la synthèse de l’ammoniac.
Exemple visuel :
- Catalyseur hétérogène en action : Schéma montrant l’utilisation du fer comme catalyseur dans le procédé Haber pour la production d’ammoniac.
3. Catalyse Enzymatique
Les enzymes sont des catalyseurs biologiques qui accélèrent les réactions chimiques dans les organismes vivants. Elles sont extrêmement spécifiques et efficaces, capables d’accélérer des réactions des millions de fois plus rapidement que si elles se déroulaient spontanément.
Exemple : L’enzyme amylase, qui catalyse la décomposition de l’amidon en sucres simples dans le corps humain.
3. Rôle des Catalyseurs dans les Réactions Chimiques
Les catalyseurs agissent en fournissant un chemin réactionnel alternatif pour les réactifs, avec une énergie d’activation plus basse. Cela permet aux réactions de se produire plus rapidement et avec moins d’énergie. Bien qu’ils accélèrent les réactions, ils ne modifient pas la position de l’équilibre chimique, mais permettent simplement d’atteindre cet équilibre plus rapidement.
Exemple visuel :
- Schéma montrant l’effet d’un catalyseur sur l’énergie d’activation : Un catalyseur abaisse l’énergie d’activation, rendant la réaction plus rapide.
Les catalyseurs peuvent être utilisés pour :
- Augmenter la vitesse de réaction dans les processus industriels.
- Améliorer le rendement en minimisant les sous-produits indésirables.
- Réduire la consommation d’énergie dans les procédés chimiques.
4. Applications des Catalyseurs
Les catalyseurs sont largement utilisés dans divers secteurs industriels et domestiques. Voici quelques-unes des principales applications :
1. Production de Produits Chimiques
Les catalyseurs sont essentiels dans la synthèse chimique, notamment pour la production de produits de grande valeur comme les plastiques, les carburants, et les engrais. Le procédé Haber-Bosch utilise un catalyseur de fer pour synthétiser l’ammoniac (NH₃), une étape clé dans la production d’engrais.
Exemple d’application : Le platine est utilisé dans la production d’acide nitrique à partir de l’ammoniac, une matière première pour la fabrication d’engrais.
Exemple visuel :
- Procédé Haber-Bosch : Utilisation du fer comme catalyseur dans la production d’ammoniac pour les engrais.
2. Catalyseurs dans l’Industrie Automobile
Les pots catalytiques utilisent des catalyseurs comme le platine, le palladium, et le rhodium pour convertir les gaz d’échappement toxiques, comme le monoxyde de carbone (CO), les hydrocarbures non brûlés, et les oxydes d’azote (NOₓ), en composés moins nocifs comme le dioxyde de carbone (CO₂), l’azote (N₂) et la vapeur d’eau (H₂O).
Exemple d’application : Les voitures modernes sont équipées de pots catalytiques pour réduire les émissions polluantes.
Exemple visuel :
- Pot catalytique : Un pot catalytique utilisé dans les voitures pour réduire les émissions polluantes.
3. Biotechnologie et Industrie Pharmaceutique
Les enzymes sont largement utilisées dans l’industrie pharmaceutique pour synthétiser des médicaments et dans les biotechnologies pour produire des biocarburants et des produits alimentaires. Les enzymes permettent de réaliser des réactions spécifiques à basse température, rendant les processus plus écologiques et plus efficaces.
Exemple d’application : L’enzyme lactase est utilisée pour produire du lait sans lactose pour les personnes intolérantes au lactose.
4. Production d’Énergie
Les catalyseurs sont également utilisés dans la production d’énergie, notamment dans les piles à combustible, qui convertissent l’hydrogène en électricité en utilisant des catalyseurs de platine. Ce procédé est plus propre que la combustion traditionnelle et ne produit que de la vapeur d’eau comme sous-produit.
Exemple visuel :
- Pile à combustible : Schéma montrant l’utilisation de catalyseurs dans une pile à combustible pour produire de l’électricité à partir d’hydrogène.
5. Avantages et Inconvénients des Catalyseurs
Avantages :
- Réduction de l’énergie nécessaire : Les catalyseurs permettent d’abaisser l’énergie d’activation et de réduire ainsi les coûts énergétiques.
- Amélioration des rendements : Les catalyseurs augmentent la vitesse des réactions et améliorent le rendement en produits souhaités.
- Respect de l’environnement : En réduisant les sous-produits nocifs et en facilitant les réactions à des températures plus basses, les catalyseurs minimisent l’impact environnemental.
Inconvénients :
- Coût élevé : Certains catalyseurs, comme le platine ou le palladium, sont coûteux à produire.
- Dégradation : Les catalyseurs peuvent perdre de leur efficacité avec le temps en raison de l’empoisonnement catalytique, où des substances étrangères bloquent les sites actifs.
- Recyclage : Certains catalyseurs, notamment dans l’industrie automobile, nécessitent des techniques de recyclage spécialisées.
6. Innovations dans la Catalyse
Les innovations en catalyse se concentrent sur le développement de nouveaux matériaux catalytiques plus efficaces, moins coûteux et plus respectueux de l’environnement. Voici quelques-unes des innovations récentes :
1. Catalyseurs à Base de Métaux Non Précieux
Pour réduire la dépendance aux métaux précieux coûteux comme le platine et le palladium, les chercheurs développent des catalyseurs à base de métaux non précieux, comme le fer ou le nickel, qui peuvent être tout aussi efficaces dans certaines réactions.
2. Catalyseurs pour Réactions à Basse Température
Les catalyseurs pour basses températures sont conçus pour permettre des réactions efficaces à des températures plus basses, réduisant ainsi la consommation d’énergie et les coûts associés.
3. Catalyseurs Biodégradables et Enzymatiques
Les catalyseurs enzymatiques continuent de se développer, notamment dans les secteurs de la chimie verte et des biocarburants, où des enzymes naturelles sont utilisées pour des processus chimiques respectueux de l’environnement.
Conclusion : L’Importance des Catalyseurs dans l’Industrie Moderne
Les catalyseurs sont indispensables dans de nombreuses industries, de la production chimique à la réduction des émissions polluantes. Grâce à leur capacité à accélérer les réactions tout en réduisant la consommation d’énergie, ils améliorent l’efficacité des procédés et réduisent les coûts. L’innovation continue dans ce domaine vise à rendre les catalyseurs plus accessibles, plus écologiques et plus durables pour répondre aux besoins de la société moderne.
FAQs
- Qu’est-ce qu’un catalyseur ? Un catalyseur est une substance qui accélère une réaction chimique sans être consommée pendant la réaction.
- Quelle est la différence entre un catalyseur homogène et hétérogène ? Un catalyseur homogène se trouve dans la même phase que les réactifs, tandis qu’un catalyseur hétérogène est dans une phase différente.
- Quelles sont les applications courantes des catalyseurs ? Les catalyseurs sont utilisés dans la production chimique, les pots catalytiques des voitures, la production d’énergie, et dans les biotechnologies.
- Comment les catalyseurs agissent-ils sur les réactions chimiques ? Les catalyseurs abaissent l’énergie d’activation nécessaire à une réaction, accélérant ainsi le processus sans modifier les produits finaux.
- Quels sont les inconvénients des catalyseurs ? Les catalyseurs peuvent être coûteux, se dégrader avec le temps et nécessiter des technologies de recyclage spécialisées.
- Quels types de catalyseurs sont utilisés dans les piles à combustible ? Les piles à combustible utilisent des catalyseurs à base de platine pour convertir l’hydrogène en électricité.
[…] Nagwa ou cet article sur la catalyse. Explorez aussi les applications pratiques avec Mediachimie et Machimie pour mieux comprendre l’importance des […]